Irgendwie denke ich bei diesem Thema an ein Flüsschen oder einen Wildbach, der den Wald, den er durchfließt, am Leben hält – zusammen mit vielen anderen Faktoren wie Sonne, Wind und Regen. Er ermöglicht nicht nur den Fischen, deren Abhängigkeit vom nassen Element offensichtlich ist, sondern unglaublich vielen Organismen erst die Existenz: Was ist mit den Tieren des Waldes? Was mit den Bäumen? Gäbe es das Moos? Was wäre mit den Tausenden von Pflanzen? Viele von ihnen würden kaum jemals ihre Blüten öffnen, gäbe es diesen Lebensquell nicht.

Dabei ist der Weg des Wassers zu ihnen oft verborgen – dennoch ist stetige Zufuhr erforderlich. Manch ein Organismus begnügt sich mit geringen Mengen, andere benötigen deutlich mehr. Überschwemmungen sind selten, auch werden sie von den überfluteten Pflanzen fast immer überlebt. Ein Austrocknen des Bachs bedeutet allerdings für einige den Untergang. Und nicht für jedes dieser wunderbaren Wesen wäre ein Zugang aus unterirdisch gespeisten Reservoirs garantiert.
Nun wollen wir dieses Bild nicht überstrapazieren – wir kommen also zum trockenen Teil des Kapitels:

Über die Bildung von Vitamin D haben wir in Kap. 2 ja schon einiges erfahren. Über seinen Transport im Blut wurden in Kap. 1 bereits ein paar Worte verloren. – Keine Angst! Wir werden auch hier nicht bis in jedes Detail gehen… Wer sich aber stärker dafür interessiert, aber nicht die Muße hat, ganze Bücher zu lesen, dem sei an dieser Stelle noch eine neuere Übersichtsarbeit von Janoušek et al. sehr ans Herz gelegt [125]. Zum ersten Verständnis der Wirkungsmöglichkeiten (angedeutet in Kap. 3 und 4) erscheint es aber äußerst hilfreich, einige wenige Zusammenhänge zu kennen. Diese seien zunächst kurz umrissen, bevor noch ein paar grundlegende biochemische Fakten dargestellt werden:
- Zu unterscheiden ist zwischen der endokrinen und der autokrinen/parakrinen Funktion von Vitamin D.
- Vitamin D, seine Speicherform Calcidiol und seine aktive Form Calcitriol haben unterschiedlich gute Möglichkeiten, an ihren Bestimmungsort zu gelangen.
- Vitamin D, Calcidiol und Calcitriol haben teils stark voneinander abweichende Halbwertszeiten.
- Daraus resultieren für eine möglichst umfassende Wirkung wichtige Vorgaben bzgl. der Art, wie Vitamin D dem Körper zur Verfügung gestellt werden sollte (siehe Kap. 13).
- Diese Einsichten sind logischerweise sowohl für Einnahme-Empfehlungen wie auch für medizinische Studien und deren Bewertung unbedingt zu berücksichtigen.
Der Weg des Vitamin D im Rahmen seiner endokrinen Funktion:
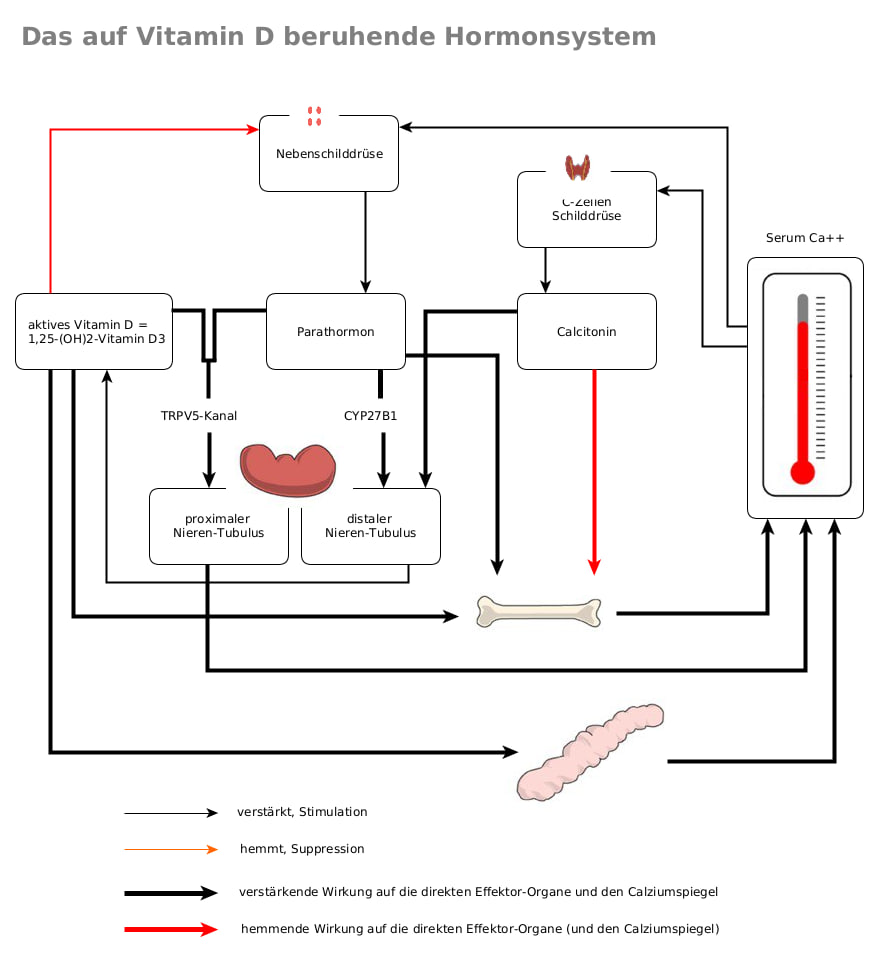
Am weitaus bekanntesten ist die endokrine Funktion von Vitamin D. Diese kommt seinem hormonellen Charakter im klassischen Sinne am nächsten und betrifft v. a. seine Wirkung auf den Kalzium-Stoffwechsel und speziell auf die Knochengesundheit. Hierzu wurde in Kap. 3 schon einiges gesagt. Auch für die endokrinen Wirkungen von Vitamin D ist letztlich sein aktiver Metabolit zuständig, also das Calcitriol (= 1,25- Di-Hydroxy-Cholecalciferol = 1,25-OH-Vitamin D3). Daher wollen wir zunächst hier nur in Kürze den Weg rekapitulieren, den das „originale“, also das „intakte“ Vitamin D gehen muss, um in seiner aktiven Form z.B. am Knochen wirken zu können:
Vitamin D3 wird von den Produktionsorten in der Haut über den Blutkreislauf zur Leber transportiert. Die mit der Nahrung aufgenommenen Vitamine D2 und D3 werden durch Chylomikronen* (45) in Blutplasma und Lymphe vom Darm* (46)ebenfalls zur Leber transportiert. In der Leber wird Vitamin D durch CYP2R1* (47) zu seiner Speicherform, dem 25-OH-Vitamin D, hydroxyliert. Nach der erneuten Freisetzung in den Blutkreislauf bindet 25-OH-Vitamin D vorwiegend an das Vitamin-D-bindende Protein (VDBP) und wird zu den Nieren und anderen Geweben transportiert. In den proximalen Tubuli* (48) der Niere führt die 1α-Hydroxylierung (CYP27B1) von 25-OH-Vitamin D zur Bildung des aktiven Vitamins Calcitriol (1,25-(OH)2-Vitamin D)* (49).
Letzteres induziert die Expression des Enzyms 24-Hydroxylase, das durch das CYP24A1-Gen kodiert wird und die Umwandlung von Calcidiol und Calcitriol in die weitgehend inaktiven* (50) 24-hydroxylierten Produkte 24,25(OH)2-Vitamin D bzw. 1,24,25(OH)3-Vitamin D katalysiert. Die Menge des produzierten Calcitriol wird aber auch durch andere Faktoren reguliert: So wird die Bildung von Calcitriol durch das Parathormon aus der Nebenschilddrüse und durch einen niedrigen Phosphorgehalt im Blut angeregt* (51). Die Aktivierung wird durch hohe Kalzium- oder Calcitriol-Konzentrationen im Blut und das Hormon FGF23 (Fibroblasten-Wachstumsfaktor 23)* (52) gehemmt* (53).
Während die Nieren der Hauptort der 1α-Hydroxylierung von 25-OH-Vitamin D zu seinem bioaktiven Metaboliten 1,25-(OH)2-Vitamin D sind, weiß man heute, dass die Aktivierung von Vitamin D auch in fast allen anderen Zellen und Geweben stattfindet. Dazu gehören auch zelluläre Komponenten sowohl des angeborenen als auch des erworbenen Immunsystems. Das unterstreicht die Rolle von Vitamin D als essentiellem Immunmodulator [127].
Man geht davon aus, dass der Pfad über Leber und Niere vor allem den Knochenstoffwechsel* (54) betrifft, die Umwandlung in den Zellen auch der übrigen Gewebe aber wichtig für die positive Wirkung von Vitamin D3 auf Autoimmunerkrankungen, Krebserkrankungen etc. ist [128].

Der Weg des Vitamin D im Rahmen seiner autokrinen Funktion:
Damit sind wir bei den autokrinen* (55) Funktionen von Vitamin D angelangt. In seiner aktiven Form, dem 1,25-(OH)2-Vitamin D, vermittelt es seine biologischen Wirkungen durch Bindung an den intrazellulären Vitamin-D-Rezeptor (VDR)* (56); dieser transportiert es in den Zellkern; der VDR rekrutiert dann Kofaktoren, um einen Transkriptionskomplex zu bilden, der sich an Vitamin-D-Reaktionselemente bindet [130]. Diese Assoziation (Verbindung) reguliert die Expression* (57) von zahlreichen* (58) Genen, die eine Vielzahl von Körperfunktionen steuern. Die nicht-klassischen Wirkungen von VDR lassen sich drei Hauptkategorien zuordnen:
- Regulierung der Hormonsekretion,
- Regulierung der Immunfunktion und
- Regulierung der Zellproliferation* (15) und -differenzierung [128].
In der Haut gebildetes oder über die Nahrung aufgenommenes Vitamin D gelangt also über das Blut zu den Körperzellen und wird in diesen umgewandelt. Da Vitamin D selbst im Blut keine lange Lebensdauer hat* (59), weil es instabil ist und sehr schnell von der Leber aufgenommen wird, ist für die Versorgung der Körperzellen eine regelmäßige Zufuhr von Vitamin D notwendig. Eine Gabe von Vitamin D über die Nahrung einmal in der Woche oder gar einmal im Monat oder eine wöchentliche Bestrahlung mit einer starken UV-Lampe – ebenso wie das nur gelegentlich wahrgenommene Sonnenbad – sorgt zwar für ggf. hohe 25-OH-Vitamin D-Blutspiegel und damit einen gesunden Knochenstoffwechsel, die meisten anderen Körperzellen erhalten aber nur wenig Vitamin D.
Das deutlich länger haltbare (t ½ ca. 19 Tage) und in viel größeren Konzentrationen vorliegende25-OH-Vitamin D wird nur zu 0,03% ungebunden im Blutplasma transportiert. Diese Speicherform steht somit in nur minimalem Umfang zur passiven Aufnahme in die Zelle durch Diffusion bereit. Die meisten Zellen sind aber nicht in der Lage, auch selbst aktiv von der Speicherform des Vitamin D etwas aufzunehmen; Ausnahmen sind die Plazenta und die Nieren (sowie in geringerem Umfang wohl auch Brustdrüse und Nebenschilddrüse); sie verfügen nämlich über das sog. Megalin/Cubilin-System* (60). Dieses ermöglicht die endozytotische* (61) Überführung des Calcidiol/VDBP-Komplexes in das Zellinnere. Für eine passive Aufnahme durch Diffusion sind die Komplexe einfach zu groß. – Das im Rahmen des „endokrinen Weges“ von den Nieren je nach Calcidiol-Spiegel eher sparsam produzierte bioaktive Calcitriol hingegen hat nur eine t ½ von 2 bis 3 (bis 5) Stunden.
Diese gerade erwähnten Aspekte des Vitamin D-Metabolismus sind für die Einschätzung der aktuellen Diskussion um die gesundheitliche Bedeutung auch im Zusammenhang mit SARS-CoV-2 ganz entscheidend!
So weist der Kinderarzt Prof. Dr. Bruce W. Hollis, eine der ganz großen Koryphäen auf diesem Gebiet, immer wieder darauf hin, dass die Bedeutung einer stabilen Serum-Konzentration des intakten Vitamin D für zahlreiche Gewebe nicht zu unterschätzen sei. Das sei aufgrund der Pharmakokinetik und speziell der recht kurzen Halbwertszeit dieser Substanz nur durch eine engmaschige, möglichst tägliche Zuführung zu gewährleisten; dies müsse man aus neuen Labordaten, klinischen Studien und aus Daten über zirkulierendes 25-OH-Vitamin D, die über viele Jahrzehnte hinweg gesammelt wurden, schließen. Eine gut nachvollziehbare schematische Darstellung bietet übrigens ein Schaubild aus einem seiner älteren Videos (min. 3:50 bis ca. 15:00) [131].
1,25-(OH)2-Vitamin D3 (Calcitriol) wird am Ende durch 24-Hydroxylase zur wasserlöslichen Calcitroinsäure abgebaut, die über die Galle* (62) ausgeschieden wird.
Was ist vom Vitamin D-Speicher zu erwarten?
Gespeichert wird Vitamin D insbesondere in seiner Speicherform als 1,25-(OH)2-Vitamin D, und zwar in der Leber, auch der Muskulatur (nur zu ca. 5 %) und vor allem im Fettgewebe* (63). Nicht zu vergessen ist das Blut bzw. dort vor allem die Vitamin D bindenden Proteine. Deren Hauptvertreter ist das VDBP, das ca. 85 % des im Plasma transportierten Vitamin D an sich bindet. Die physiologische Hauptfunktion von VDBP ist ja die Regulierung der gesamten und frei zirkulierenden Spiegel von Vitamin-D-Metaboliten. Das VDBP fungiert als ihr zirkulierendes Reservoir [132].
Die genaue Größe der Vitamin-D-Körperspeicher ist sehr individuell. Bei Normalgewichtigen wird von etwa 20.000 bis 100.000 IE ausgegangen [133, 134, 135, 136, 137]. Studien konnten zeigen, dass 1 kg Fettgewebe durchschnittlich etwa 4000 IE Vitamin D enthalten – dies entspräche bei 70 kg Körpergewicht ebenfalls einem Gesamt-Speicher von rund 100.000 IE [138]. Dabei variiert die tatsächliche Größe natürlich je nach Körpermasse und Vitamin-D-Aufnahme. In sehr fettleibigen Menschen wurden Vitamin-D-Körperspeicher bis zu 400.000 IE errechnet [139].
Um nennenswerte Vitamin-D-Körperspeicher aufzubauen, ist zumindest für einige Zeit die Aufnahme oder Produktion von Vitamin D weit über den täglichen Bedarf hinaus nötig. Diese Reserve reicht nur für relativ kurze Zeit und ist nicht geeignet, einen vernünftigen Vitamin-D-Spiegel längere Zeit aufrecht zu erhalten. Bei niedrigem BMI* (64) ist ebenfalls nicht damit zu rechnen, dass die Körperspeicher einen relevanten Beitrag zur Vitamin-D-Versorgung leisten können.
Es wird davon ausgegangen, dass ständig Vitamin D aus dem und in den Körperspeicher diffundiert. Dabei wird Vitamin D nur langsam und in kleinen Mengen vom Fettgewebe wieder abgegeben. Freigesetzt werden die Körperspeicher im Wesentlichen nur beim Abbau der Fettgewebe durch Fasten/Hungern [140]. (Auch dies war ja in früheren Zeiten – der Not gehorchend – oft gerade im Winter ein gewöhnlicher Vorgang, zumindest in reicheren Ländern findet heutzutage Jahr für Jahr eher das Gegenteil statt.) Auch wenn man die Gesamtgröße der Körperspeicher von rund 100.000 IE betrachtet, wird schnell klar, dass ihr Beitrag zur Vitamin-D-Versorgung nur begrenzt sein kann: Bei einem Gesamtbedarf von 2000-5000 IE täglich reichen diese Speicher theoretisch für maximal ca. 20 bis 50 Tage.
Wenngleich also die Körperspeicher vielleicht eine evolutionäre Absicherung für die teils harten Winter waren, dürften sie diese Rolle in der modernen Welt nur noch sehr bedingt erfüllen.

Anmerkungen (*):
(45): Chylomikronen sind winzige Fetttröpfchen, eigentlich Lipoproteinpartikel, von 0,5 bis 1,0 µm Durchmesser. Sie transportieren die im Dünndarm aufgenommenen Nahrungsfette unter Umgehung der Leber über das Lymphsystem in den großen Blutkreislauf und bestehen zu 99% aus Fetten. Davon machen die Neutralfette, die sog. Triglyceride, mit 90% bzw. die Phospholipide mit 5% die größten Fraktionen aus.
(46): Aufnahme erfolgt in den oberen Abschnitten des Dünndarms.
(47): CYP steht für Cytochrom P450. Die Cytochrome P450 sind Hämproteine mit enzymatischer Aktivität (Oxidoreduktasen), die üblicherweise aus ca. 500 Aminosäuren bestehen. Sie sind überwiegend in der Membran des Endoplasmatischen Retikulums verankert. Sie kommen praktisch in allen Formen des Lebens vor. In Tieren wurden sie in allen Organen, insbesondere in der Leber, nachgewiesen. Beim Menschen wurden 57 verschiedene CYPs gefunden, die auch hier vorwiegend in der Leber vorkommen, aber auch im Darm und in geringem Ausmaß in anderen Organen. Ihr aktives Zentrum, das die katalytische Aktivität auslöst, ist ein Eisen (III)-Ion. Sie reagieren fast ausschließlich als Monooxygenasen (Überträger eines einzelnen Sauerstoff-Atoms). Der wichtigste Reaktionstyp ist die Hydroxylierung nicht-aktivierter Kohlenstoff-Wasserstoff-Bindungen, dabei werden Sauerstoff und Wasserstoff verbraucht. R − H + 2 e − + 2 H + + O 2 ⟶ R − O H + H 2 O {\displaystyle \mathrm {R{-}H+2e^{-}+2H^{+}+O_{2}\longrightarrow R{-}OH+H_{2}O} } CYPs leisten einen wichtigen Beitrag bei der Verstoffwechselung wasserunlöslicher Stoffe durch Oxidation. Diese werden dadurch besser wasserlöslich und können schneller aus dem Körper ausgeschieden werden („Biotransformation“).
Als Substrate, also zu verändernde Substanzen, kommen sowohl körpereigene als auch körperfremde Stoffe (z. B. Arzneimittel) in Frage. Daneben sind CYPs an wichtigen Schritten der Synthese von Steroidhormonen, Prostaglandinen, Retinoiden und eben auch von Vitamin D3 (z. B. durch das CYP27B1) beteiligt. Eine spezielle Namensgebung bei den zahlreichen Untertypen von Cytochrom P450 sorgt für mehr Ordnung.
Als Vertreter im menschlichen Organismus seien beispielhaft genannt: CYP1A1, CYP1A2, CYP1B1, CYP2A6, CYP2C9, CYP2C19, CYP2D6, CYP2R1, CYP27A1, CYP27B1, CYP46A1, CYP51A1.
(48): Das ist der „vordere“, also zuerst vom Primärharn durchflossene Teil des von der Niere zur Blutreinigung zur Verfügung gestellten mikroskopisch kleinen Röhrensystems. Jedes dieser Röhrchen (Tubuli) gehört zu einer der ca. 1 Mio. funktionellen Untereinheiten, die jede menschliche Niere hat. Hauptaufgabe ist die weitere Konzentrierung des Urins.
(49): Mit zunehmendem Alter nimmt jedoch die Fähigkeit der Nieren, 25-OH-Vitamin D3 zu aktivieren, ab.
(50): Gemeint ist hier speziell hormonell inaktiv; das heißt keinesfalls, dass nicht auch solchen Substanzen in unserem hochkomplizierten Organismus eine Funktion zukommen könnte. So wird z. B. vermutet, dass 24,25-(OH)2-Vitamin D eine negative Wirkung auf die 1,25-(OH)2-Vitamin D3-Signalgebung hat und möglicherweise die Umwandlung von 25-OH-Vitamin D in 1,25-(OH)2-Vitamin D3 in einer negativen Rückkopplungsschleife hemmt. Interessanterweise blieb in einer sportmedizinischen Studie [126] der 24,25-(OH)2-Vitamin D-Metabolit nach Absetzen einer hochdosierten Nahrungsergänzung bei den Sportlern erhöht, obwohl 25-OH-Vitamin D und 1,25-(OH)2-Vitamin D3 absanken. Man könnte zumindest darüber spekulieren, ob eine anhaltende Erhöhung von 24,25-(OH)2-Vitamin D angesichts des Rückgangs von aktivem 1,25-(OH)2-Vitamin D3 zum gegenteiligen Effekt führen könnte als beabsichtigt.
(51): Die Synthese von 1,25-(OH)2-Vitamin D3 wird durch zahlreiche Faktoren gesteuert. Die wichtigsten sind jedoch die zirkulierenden Mengen an Parathormon (,dessen Sekretion durch niedriges Serumkalzium stimuliert wird), die Phosphorkonzentrationen im Serum oder in der extrazellulären Flüssigkeit, die zirkulierenden Mengen an 1,25-(OH)2-Vitamin D3 selbst und das Serumkalzium selbst. So steigt bei niedrigem Kalziumspiegel die 1,25-(OH)2-Vitamin D3-Synthese aufgrund einer erhöhten Aktivität des Parathormons. Nebenschilddrüsenhormone können diese Synthese direkt oder über Veränderungen (eine Abnahme) des Serumphosphors oder beides stimulieren. Ein niedriges Serumphosphor stimuliert die 1,25-(OH)2-Vitamin D3-Synthese unabhängig vom Parathormonspiegel. Niedriges Serum-Calcium kann die 1-Alpha-Hydroxylase-Aktivität von 25-OH-Vitamin D3 unabhängig von den Nebenschilddrüsenhormonen direkt anregen. Generell neigt das Vitamin-D-Hormonsystem dazu, Anomalien der Kalzium- und Phosphorhomöostase zu korrigieren.
(52): Der aus dem Knochen (Osteozyten und teilweise Osteoblasten) stammende Fibroblasten-Wachstumsfaktor 23 (FGF23) reduziert die Serumkonzentration von Phosphat auf dreierlei Weise:
- erhöhte Phosphatausscheidung mit dem Urin durch Hemmung des Natrium-Phosphat-Cotransporters im proximalen Tubulus
- Hemmung der PTH-Sekretion in der Nebenschilddrüse. Dadurch geringere Mobilisation von Phosphat aus dem Knochen.
- Hemmung der 1α-Hydroxylase, die für die renale Synthese von Calcitriol entscheidend ist. Weiterhin Hemmung der 24-Hydroxylase, die Calcitriol inaktiviert. Insgesamt wird dadurch weniger Phosphat aus dem Magen-Darm-Trakt aufgenommen.
Synthese und Freisetzung von FGF23 werden u.a. stimuliert durch: Hyperphosphatämie, phosphatreiche Ernährung, Parathormon (PTH), Calcitriol und Kalzium. Gehemmt wird die FGF23-Produktion durch das Dentin-Matrix-Protein-1 (DMP1) und die Ektonucleotid-Pyrophosphatase/Phosphodiesterase 1 (ENPP1).
(53): Man darf hierin durchaus eine weitere Art Schutzmechanismus gegen negative Auswirkungen des aktiven Vitamin D sehen, also eine weitere (relative) Schranke gegen Vitamin D-Vergiftung durch negatives Feed-back.
(54): Dabei spielt Calcitriol keineswegs nur wegen des Kalzium- und Phosphat-Haushaltes eine so große Rolle für den Knochenstoffwechsel, sondern auch durch seine Wirkung auf die Osteoblasten: Reifung und Anregung der Bildung von Osteocalcin sowie Bildung von Hydroxylapatit-Kristallen (Mineralisierung) im Knochen, wo Calcitriol gleichzeitig die Reifung und Resorptionstätigkeit der Osteoklasten stimuliert und dadurch den Umbau des Knochens beschleunigt.
(55): Autokrine Sekretion ist ein Sekretionsmechanismus von Zellen, bei dem die abgegebenen Hormone und hormonähnlichen Substanzen, zum Beispiel Wachstumsfaktoren, auf die absondernde Zelle selbst wirken. Voraussetzung ist, dass die Zelle Rezeptoren für die von ihr gebildeten Signalstoffe besitzt. Wie bei der parakrinen Sekretion und im Gegensatz zur endokrinen Sekretion gelangen die Hormone dabei nicht über das Blut zu ihrer „Zielzelle“, sondern wirken in direkter Umgebung. Als autokrin bezeichnet man einen Sekretionsmodus, bei dem Drüsenzellen ihre Produkte in den Zell-Zwischenraum (das „Interstitium“) ihrer unmittelbaren Umgebung abgeben, so dass sie auf die sezernierende Zelle selbst zurückwirken. Autokrine Wirkungen haben viele Gewebshormone und Zytokine, aber auch klassische Hormone wie Insulin oder TSH.
(56): Selbstverständlich kann das Wirksamwerden von Vitamin D manchmal auch auf dieser Ebene scheitern oder eingeschränkt sein, wenn nämlich die VDR dysfunktional sind, also – meist auf Grundlage struktureller Defizite – ihre Aufgabe nicht wahrnehmen können. Das führt zu Entzündung und beeinträchtigt die Mitochondrien. Außerdem führt eine Zufuhr von Vitamin D dann nicht nur nicht zu den gewünschten Effekten, sondern kann sich sogar kontraproduktiv auswirken [129]. Hierauf soll in diesem Rahmen allerdings nicht eingegangen werden, um das Thema nicht ausufern zu lassen.
(57): Expression: Wenn ein Gen exprimiert wird, bedeutet dies, dass es abgelesen werden kann (Stichworte Transkription, Messenger-RNA). Es zeigt sich quasi den dafür zuständigen Strukturen seiner Zelle, die dann die im Gen verschlüsselte Information in Form einer Eiweisverbindung realisieren können.
(58): Mittlerweile sind schon mehr als 2000 entsprechende Gene beim Menschen bekannt.
(59): Sie beträgt ca. 1 Tag, für das in unserem Zusammenhang vor allem interessante über die Nahrung aufgenommene Vitamin D besteht sogar nur eine t ½ von 4 bis 6 Stunden.
(60): Megalin ( = Low Density Lipoprotein receptor-related Protein 2 = LRP2) ist ein Protein in der Zellmembran mehrerer Gewebe, ein sogenannter Rezeptor. Megalin gehört zu einer Rezeptorfamilie, die strukturelle Ähnlichkeiten mit dem LDL-Rezeptor hat. Mit 4630 Aminosäuren ist es ein sehr großes Protein. Es ist hauptsächlich in Epithelgewebemembranen zu finden und sorgt dort zusammen mit seinem Partner Cubilin durch Membrantransport (Endozytose) für die Absorption vieler Stoffe in die Zelle.
(61): Endozytose ist so etwas wie der Fressvorgang der Zelle, welche umgebende Flüssigkeit oder Partikel bzw. eine Verbindung amöbenartig umfließt. Dabei kommt es zur Einstülpung in Bereichen der Zellmembran, die dann abgeschnürt und als Vesikel (Bläschen) ins Zellinnere abgegeben werden.
(62): Allerdings unterliegt auch diese Substanz dem sog. enterohepatischen Kreislauf; d. h., sie wird über Darm und Leber zu einem großen Teil dem Körper wieder zur Verfügung gestellt.
(63): Dort wird in erster Linie Calcidiol, in geringeren Mengen aber auch intaktes Vitamin D sowie Calcitriol gespeichert.
(64): BMI = Body Mass Index – ein (in seiner Bedeutung durchaus umstrittener) Indikator für Über- oder Untergewicht, errechnet über Gewicht und Körpergröße.
Quellen:
[125]: Jiří Janoušek, Veronika Pilařová, Kateřina Macáková, Anderson Nomura, Jéssica Veiga-Matos, Diana Dias da Silva, Fernando Remião, Luciano Saso, Kateřina Malá-Ládová, Josef Malý, Lucie Nováková & Přemysl Mladěnka (2022) Vitamin D: sources, physiological role, biokinetics, deficiency, therapeutic use, toxicity, and overview of analytical methods for detection of vitamin D and its metabolites, Critical Reviews in Clinical Laboratory Sciences, 59:8, 517-554, https://doi.org/10.1080/10408363.2022.2070595.
[126]: Owens DJ, Tang JC, Bradley WJ, et al. Efficacy of high-dose vitamin D supplements for elite athletes. Med Sci Sports Exerc. 2017;49:349–356. https://doi.org/10.1249/MSS.0000000000001105.
[127]: Sassi F, Tamone C, D’Amelio P. Vitamin D: Nutrient, Hormone, and Immunomodulator. Nutrients. 2018 Nov 3;10(11):1656. https://doi.org/10.3390/nu10111656.
[128]: Hollis BW, Wagner CL. Clinical review: The role of the parent compound vitamin D with respect to metabolism and function: Why clinical dose intervals can affect clinical outcomes. J Clin Endocrinol Metab. 2013 Dec;98(12):4619-28. https://doi.org/10.1210/jc.2013-2653.
[129]: SCHILLING, F. 2021. Vitamin D – Moderne Mythen und ambivalente Immunologie. OM & Ernährung https://deutsche-gesellschaft-fuer-naturstoffmedizin-und-epigenetik.de/wp-content/uploads/DGName_VDR_Artikel_dt.pdf.
[130]: Yang L, Ma J, Zhang X, Fan Y, Wang L. Protective role of the vitamin D receptor. Cell Immunol. 2012 Oct;279(2):160-6. https://doi.org/10.1016/j.cellimm.2012.10.002.
[131]: https://www.youtube.com/watch?v=FbheaULwRAk.
[132]: Safadi FF, Thornton P, Magiera H, Hollis BW, Gentile M, Haddad JG, Liebhaber SA, Cooke NE. Osteopathy and resistance to vitamin D toxicity in mice null for vitamin D binding protein. J Clin Invest. 1999 Jan;103(2):239-51. https://doi.org/10.1172/JCI5244.
[133]: Heaney RP, Horst RL, Cullen DM, Armas LA. Vitamin D3 distribution and status in the body. J Am Coll Nutr. 2009 Jun;28(3):252-6. Review. PubMed PMID: 20150598. https://www.researchgate.net/deref/https%3A%2F%2Fdoi.org%2F10.1080%2F07315724.2009.10719779.
[134]: Blum M, Dolnikowski G, Seyoum E, et al. Vitamin D(3) in fat tissue. Endocrine. 2008; 33(1):90–94. Blum M, Dolnikowski G, Seyoum E, Harris SS, Booth SL, Peterson J, Saltzman E, Dawson-Hughes B. Vitamin D(3) in fat tissue. Endocrine. 2008 Feb;33(1):90-4. https://doi.org/10.1007%2Fs12020-008-9051-4.
[135]: Beckman LM, Earthman CP, Thomas W, et al. Serum 25(OH) vitamin D concentration changes after roux-en-Y gastric bypass surgery. Obesity (Silver Spring). 2013;21(12):E599–606. https://doi.org/10.1002%2Foby.20464.
[136]: Robert P. Heaney and Laura A.G. Armas. Quantifying the vitamin D economy. Nutrition Reviews VR Vol. 73(1):51–67. https://doi.org/10.1093/nutrit/nuu004.
[137]: Carrelli, A., Bucovsky, M., Horst, R., Cremers, S., Zhang, C., Bessler, M., … & Stein, E. M. (2016). Vitamin D Storage in Adipose Tissue of Obese and Normal Weight Women. Journal of Bone and Mineral Research. https://doi.org/10.1002/jbmr.2979.
[138]: Lawson DE, Douglas J, Lean M, Sedrani S. Estimation of vitamin D3 and 25-hydroxyvitamin D3 in muscle and adipose tissue of rats and man. Clin Chim Acta. 1986 Jun 15;157(2):175-81. https://doi.org/10.1016/0009-8981(86)90223-8.
[139]: Pramyothin P, Biancuzzo RM, Lu Z, Hess DT, Apovian CM, Holick MF. Vitamin D in adipose tissue and serum 25-hydroxyvitamin D after roux-en-Y gastric bypass. Obesity (Silver Spring). 2011 Nov;19(11):2228-34. https://doi.org/10.1038/oby.2011.170.
[140]: Gangloff, A., Bergeron, J., Lemieux, I., & Després, J. P. (2016). Changes in circulating vitamin D levels with loss of adipose tissue. Current Opinion in Clinical Nutrition & Metabolic Care. https://doi.org/10.1097/mco.0000000000000315.

