Das Vitamin für die Knochen
Vitamin D ist vor allem bekannt für seine endokrine Funktion, die es für den Magnesium-, Phosphat- und insbesondere für den Kalzium-Stoffwechsel hat, und damit für den Aufbau einer gesunden Knochenstruktur und vor allem -mineralisation.
Es regelt in Wechselwirkung mit den Hormonen Calcitonin (gebildet in der Schilddrüse) und Parathormon (PTH) (gebildet in der Nebenschilddrüse) den Kalzium-Haushalt des Körpers, wobei u.a. aus Gründen der Herzfunktion die wichtigste Stellgröße der Kalziumspiegel im Blut ist. Vitamin D führt zu einer dosisabhängigen Steigerung der Kalziumaufnahme aus dem Darm; ohne Vitamin D wird dieses nur zu 10 bis 15% resorbiert, nach anderen Angaben praktisch gar nicht, und Phosphat nur zu 60%; bei ausreichender Vitamin D-Versorgung hingegen werden 30 bis 40% des Kalziums und 80% des Phosphats aus dem Darm aufgenommen.
Bei einem Mangel produziert die Nebenschilddrüse* (13) vermehrt PTH (maximal bei einem 25-OH-Vitamin D-Spiegel unterhalb von etwa 20 ng/ml* (14)). Dadurch wird Kalzium (außer aus dem Darm und durch die sog. Rückresorption aus der Niere) insbesondere aus den Knochen ins Blut mobilisiert wird, um wenigstens dort eine ausreichende Konzentration zu gewährleisten.
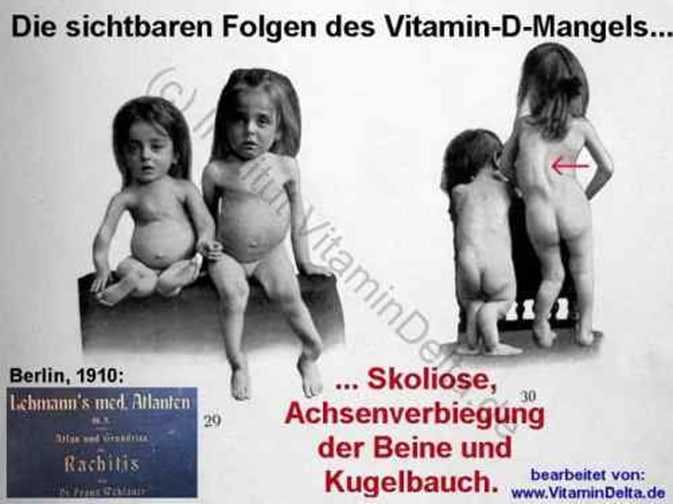
Klassischerweise finden sich bei einem D3-Mangel schon im Kindesalter erhebliche orthopädische Störungen im Rahmen einer Rachitis; diese äußert sich in relativ weichen und biegsamen Knochen mit entsprechenden Fehlbildungen, Haltungsschäden und Fehlbelastungen; Beispiele sind Kyphose, Skoliose (Wirbelsäulen-Verkrümmung), Craniotabes (Kugelkopf, manchmal sogar mit Hydrocephalus als Folge, also Wasserkopf), Zahnschmelzdefekte, gehäufte Karies, extreme X- oder O-Beine, Starkes Hohlkreuz, Froschbauch, Hühnerbrust oder Trichterbrust.
unabhängig davon können im Erwachsenenalter Osteomalazie (Knochenerweichung), verbunden mit Schmerzen v. a. im Bereich von Rücken und/oder Brust sowie Muskelschwäche, oder – v. a. in Kombination mit anderen Faktoren wie Bewegungsmangel – Osteoporose auftreten mit Knochenschmerzen und vermehrter Knochenbrüchigkeit. Im Zusammenhang mit dem Bewegungsapparat ist eine verbesserte muskuläre Funktion bei optimierter Vitamin D-Versorgung bekannt, auch außerhalb der erwähnten Knochenerweichung.
Vitamin D ist wichtig – für viel, viel mehr
Die Regulierung des Kalzium-Haushalts oder gar ausschließlich die orthopädischen Aspekte sind jedoch bei Weitem nicht die einzigen Funktionen, die Vitamin D innehat.
Insbesondere seit Ende der 1980er und ganz verstärkt in den letzten 15 bis 20 Jahren hat es einen enormen Zuwachs an wissenschaftlichen Erkenntnissen gerade in Bezug auf Vitamin D gegeben – der Geschichte des Vitamin D werden wir mit dem Kap. 18 auch noch einen eigenen Abschnitt widmen. Diese Forschungsergebnisse belegen mannigfaltige Funktionen speziell der aktivierten Form, also des eigentlichen Hormons (Calcitriol), in praktisch sämtlichen Körperzellen. Diese haben in den unterschiedlichsten Geweben des menschlichen Körpers Rezeptoren für Vitamin D bzw. können aufgenommenes Vitamin D selbst mithilfe von zwei Enzymen und unter Verbrauch von Magnesium in 25-OH-Vitamin D und 1,25-OH-Vitamin D umwandeln. Die entscheidende Frage ist nur: Wie kann Vitamin D in relevanter Menge dort hineingelangen – relativ lange schon gut bekannt ist das nur für einen ganz „erlauchten Kreis“ von Zellarten – Stichwort Knochen. Aber dazu mehr im Kapitel 8.
Dreh- und Angelpunkt bei der Zuschreibung funktioneller Wirkungen auf die oft ganz unterschiedlichen Zellen ist die Fähigkeit der aktiven Form von Vitamin D, einzelne Gene abzulesen. Mittlerweile sind über 2000 davon als solche identifiziert, deren Ein- oder Ausschalten eng mit der Anwesenheit von Calcitriol verbunden ist! Insofern wundert es nicht, daß es inzwischen auch eine nahezu unüberschaubare Zahl von Krankheiten und Symptomen gibt, die mit Vitamin D in Zusammenhang gebracht werden. Betroffen sind als wichtigste vor allem folgende Bereiche:
Knochen- und Bindegewebs-Struktur, Muskulatur, Nervensystem, Immun-System, Zellproliferation* (15), Zell-Differenzierung und Apoptose* (16) sowie (damit auch) Krebs-Resistenz und Autoimmun-Krankheiten sowie endokrine Organe.
Als konkrete Beispiele seien hier genannt: Rachitis, Gingiva-Hyperplasie (Zahnfleisch-Wucherung), Myalgie (Muskelschmerzen, v.a. der Oberschenkelstrecker und/ oder im Schultergürtel), Morbus Alzheimer, Multiple Sklerose, Infektions-Anfälligkeit für virale wie auch bakterielle Erreger, Altersabhängige Makula-Degeneration der Augen (AMD) [12 ; 13 ; 14], Systemischer Lupus Erythematodes (eine rheumatische Erkrankung), Morbus Crohn (chronisch-entzündliche Darm-Erkrankung), Psoriasis vulgaris (gemeine Schuppenflechte), Vitiligo (Weißflecken-Krankheit), Alopecia areata (kreisrunder Haarausfall) [15; 16], verschiedene Carzinome (z.B. Prostata-Carzinom und Mamma-Carzinom, also Brustkrebs), Bluthochdruck [17 – 30], Fettleibigkeit [31], Diabetes mellitus (Typ II wie auch Typ I) sowie eine erhöhte Komplikationsrate in der Schwangerschaft incl. Präeklampsie [32, 33].
Bei der Blutdruck-Regulation gibt es auch einen bekannten physiologischen Zusammenhang [34, 35], dessen Beeinträchtigung im Übrigen auch bei Covid 19 eine nicht ganz unbedeutende Rolle spielen dürfte (hierzu mehr in Kapitel 5).
Ein weiterer Bezug zur hormonellen Steuerung unseres Körpers besteht im Einfluss auf die Ausschüttung von Schilddrüsen-Hormon und auf die Insulin-Sekretion.
Sogar darauf, daß ausreichende Vitamin D-Versorgung einer allgemeinen Verkürzung der Lebenserwartung entgegenwirken könnte, gibt es zumindest indirekte Hinweise [36].

Umstritten
Der Zusammenhang zwischen niedrigen Vitamin D–Werten und verschiedenen chronischen Krankheiten wurde in zahlreichen Studien untersucht und vermutet. Bislang konnten allerdings insgesamt keine eindeutigen Beweise, dass der Mangel die Erkrankung ausgelöst hat, gefunden werden [37].
Studien, die einen solchen (kausalen) Zusammenhang zu einzelnen Erkrankungen zumindest für bestimmte Populationen, also Teile der Bevölkerung, nahelegen, sind umstritten; zum einen gibt es Studien, die das Gegenteil zu zeigen scheinen, zum anderen werden den Studien methodische Schwächen (wie z.B. zu kleine Fallzahlen, unzureichende Verblindung, mangelnde Randomisierung, also vergleichbare Zuschreibung der Studien-Teilnehmer zu den einzelnen Studienarmen, d.h. Behandlungs-Gruppen) angelastet; hier muß man allerdings sagen, daß es auf keinem medizinischen Gebiet Studien gibt, an denen man keinerlei Schwächen finden könnte.
Immerhin sind die Studien, die einen positiven Effekt von Vitamin D-Unterstützung nicht gefunden haben, meist auch mit sogar erheblichen Mängeln behaftet wie einer zu geringen Dosierung (Beispiel: [38]), zu großem Einnahme-Intervall (einige Beispiele: [39], [40], [41], [42], [43]), fehlender oder unzureichender Kontrollen der Vitamin D-Spiegel, geringer Compliance (also Einnahme-Sicherheit der Probanden), Beschränkung oder zumindest Standardisierung aller teilnehmenden Gruppen hinsichtlich Sonnenexposition, etc.
Weiterhin wird – ähnlich wie im Hinblick auf Covid 19 (hierzu mehr in Kap. 5 und 6!) – immer wieder betont, daß in vielen der effektpositiven Studien zu Vitamin D nur Korrelationen nachgewiesen seien, aber keine Kausalität.
Dabei wird im Allgemeinen die Hypothese in den Raum gestellt, daß bei vielen der untersuchten Erkrankungen ja eine Entzündung im Körper vorliege, und die könne ja die Ursache für den Vitamin D-Mangel sein. Das ist theoretisch nicht von vornherein auszuschließen, allerdings sollte man u.a. auch bedenken, daß ein ausreichend hoher Vitamin D-Spiegel entzündliche Prozesse entscheidend reguliert und sehr häufig gerade dazu beiträgt, überschießende Entzündungs-Reaktionen des Körpers abzubremsen bzw. zu stoppen.
Zusammenfassung:
Vitamin D ist u. a. wichtig für den Stoffwechsel von Magnesium, Phosphat und v. a. Kalzium und damit auch für die Knochengesundheit.
Darüber hinaus erfüllt es zahlreiche Funktionen. Der entscheidende Mechanismus hierfür ist das Ablesen verschiedener Gene über das aktive Vitamin D (Calcitriol = 1,25-(OH)2-Vitamin D3) im Zellkern.
Sowohl zu wenig 1,25-Vitamin D als auch zu viel 1,25-OH-Vitamin D können zu unerwünschten Regulationen des Stoffwechsels führen.
Betroffen sind unter anderem: Knochen und Bindegewebe, Muskulatur, Nervensystem, Immunsystem, Zellproliferation (Krebsentwicklung, Zellerneuerung, Reparaturprozesse), Zelldifferenzierung.
Hinsichtlich zahlreicher Erkrankungen besteht eine klare Assoziation mit einer Vitamin D-Unterversorgung.
Ein anhaltender wissenschaftlicher Streit besteht zumindest im Hinblick auf einen Großteil dieser Erkrankungen bezüglich der Interpretation dieses Zusammenhangs als kausal (ursächlich) oder rein korrelativ (statistisch miteinander verbunden).
Anmerkungen (*):
(13): Diese heißt so, weil sie hinter der Schilddrüse ganz dicht an dieser anliegt; eigentlich hat sie mit ihr funktionell so gut wie nichts zu tun; genau genommen handelt es sich bei ihr um eine Ansammlung mehrerer (meist 4) Drüsen, sog. Epithelkörperchen. Bei einer Erkrankung oder gar Verlust (meist im Rahmen von Autoimmunerkrankung oder durch Schilddrüsen-Operation) der Nebenschilddrüse sind hinsichtlich der Vitamin D-Gabe besondere Maßstäbe anzulegen.
(14): Diese Feststellung und die Beobachtung, daß ab einem Calcidiol-Spiegel von 20 ng/ml die Gegenregulation durch die Nebenschilddrüse zunehmend und ab einem Calcidiol-Spiegel von 30 ng/ml komplett zurückgenommen wird, lässt die Einordnung eines Spiegels unterhalb von Werten zwischen 20 und 30 als Mangel durchaus rational erscheinen. Zu den entsprechenden Grenzwerten erfahren wir mehr im Kap. 9 und Kap. 13.
(15): Das bedeutet schnelles Wachstum beziehungsweise Vermehrung von Gewebe, umgesetzt durch Zellteilung und Zellwachstum.
(16): Apoptose ist der kontrollierte, durch Genexpression gesteuerte „Selbstmord“ der Zelle, der im Gegensatz zur Nekrose nicht die Freisetzung des Zell-Inneren (Zellplasma) beinhaltet und somit keine Entzündungsreaktion auslöst. Dieser genetisch programmierte Zelltod ist für die Entwicklung vielzelliger Organismen notwendig.
Quellen:
[12]: Kim EC, Han K, Jee D. Inverse relationship between high blood 25-hydroxyvitamin D and late stage of age-related macular degeneration in a representative Korean population. Invest Ophthalmol Vis Sci 2014;55(8):4823-31. doi: 10.1167/iovs.14-14763.
[13]: Millen AE, Voland R, Sondel SA, Parekh N, Horst RL, Wallace RB, Hageman GS, Chappell R, Blodi BA, Klein ML, Gehrs KM, Sarto GE, Mares JA; CAREDS Study Group. Vitamin D status and early age-related macular degeneration in postmenopausal women. Arch Ophthalmol 2011;129(4):481-9. doi.org/10.1001/archophthalmol.2011.48.
[14]: Morrison MA, Silveira AC, Huynh N, Jun G, Smith SE, Zacharaki F, Sato H, Loomis S, Andreoli MT, Adams SM, Radeke MJ, Jelcick AS, Yuan Y, Tsiloulis AN, Chatzoulis DZ, Silvestri G, Kotoula MG, Tsironi EE, Hollis BW, Chen R, Haider NB, Miller JW, Farrer LA, Hageman GS, Kim IK, Schaumberg DA, DeAngelis MM. Systems biology-based analysis implicates a novel role for vitamin D metabolism in the pathogenesis of age-related macular degeneration. Hum Genomics. 2011 Oct;5(6):538-68. doi: 10.1186/1479-7364-5-6-538.
[15]: Alam M, Amin SS, Adil M, Arif T, Zahra FT, Varshney I. Comparative Study of Efficacy of Topical Mometasone with Calcipotriol versus Mometasone Alone in the Treatment of Alopecia Areata. Int J Trichology. 2019 May-Jun;11(3):123-127. doi: 10.4103/ijt.ijt_18_19.
[16]: A. A. Çerman, S. S. Solak, Altunay, N. A. Küçükü: Topical Calcipotriol Therapy for Mild-to-Moderate Alopecia Areata: A Retrospective Study. In: Journal of Drugs in Dermatology. Band 14, Nummer 6, Juni 2015, S. 616–620, PMID 26091388
[17]: E S Orwoll, S Oviatt, Relationship of mineral metabolism and long-term calcium and cholecalciferol supplementation to blood pressure in normotensive men, The American Journal of Clinical Nutrition, Volume 52, Issue 4, October 1990, Pages 717–721, https://doi.org/10.1093/ajcn/52.4.717 ;
[18]:Pan WH, Wang CY, Li LA, Kao LS, Yeh SH. No significant effect of calcium and vitamin D supplementation on blood pressure and calcium metabolism in elderly Chinese. Chin J Physiol. 1993;36(2):85-94. Erratum in: Chin J Physiol 1993;36(3):192. PMID: 8198625. ;
[19]: Geneviève C Major, Francine Alarie, Jean Doré, Sakouna Phouttama, Angelo Tremblay, Supplementation with calcium + vitamin D enhances the beneficial effect of weight loss on plasma lipid and lipoprotein concentrations, The American Journal of Clinical Nutrition, Volume 85, Issue 1, January 2007, Pages 54–59, https://doi.org/10.1093/ajcn/85.1.54;
[20]: Sugden, J.A., Davies, J.I., Witham, M.D., Morris, A.D. and Struthers, A.D. (2008), Vitamin D improves endothelial function in patients with Type 2 diabetes mellitus and low vitamin D levels. Diabetic Medicine, 25: 320-325. https://doi.org/10.1111/j.1464-5491.2007.02360.x ;
[21]: Zittermann A, Frisch S, Berthold HK, Götting C, Kuhn J, Kleesiek K, Stehle P, Koertke H, Koerfer R. Vitamin D supplementation enhances the beneficial effects of weight loss on cardiovascular disease risk markers. Am J Clin Nutr. 2009 May;89(5):1321-7. doi: 10.3945/ajcn.2008.27004 ;
[22]: Daly RM, Nowson CA. Long-term effect of calcium-vitamin D(3) fortified milk on blood pressure and serum lipid concentrations in healthy older men. Eur J Clin Nutr. 2009 Aug;63(8):993-1000. doi: 10.1038/ejcn.2008.79. ;
[23]: Nagpal J, Pande JN, Bhartia A. A double-blind, randomized, placebo-controlled trial of the short-term effect of vitamin D3 supplementation on insulin sensitivity in apparently healthy, middle-aged, centrally obese men. Diabet Med. 2009 Jan;26(1):19-27. doi: 10.1111/j.1464-5491.2008.02636.x. ;
[24]: Margolis KL, Ray RM, Van Horn L, Manson JE, Allison MA, Black HR, Beresford SA, Connelly SA, Curb JD, Grimm RH, Kotchen TA, Kuller LH, Wassertheil-Smoller S, Thomson CA, Torner JC; Women’s Health Initiative Investigators. Effect of calcium and vitamin D supplementation on blood pressure: the Women’s Health Initiative Randomized Trial.Hypertension. 2008; 52:847–855. https://doi.org/10.1161/HYPERTENSIONAHA.108.114991 ;
[25]: Jorde R, Sneve M, Torjesen P, Figenschau Y. No improvement in cardiovascular risk factors in overweight and obese subjects after supplementation with vitamin D3 for 1 year. J Intern Med. 2010 May;267(5):462-72. doi: 10.1111/j.1365-2796.2009.02181.x. ;
[26]: Scragg R, Khaw KT, Murphy S. Effect of winter oral vitamin D3 supplementation on cardiovascular risk factors in elderly adults. Eur J Clin Nutr. 1995 Sep;49(9):640-6. PMID: 7498100. ;
[27]: Pfeifer M, Begerow B, Minne HW, Nachtigall D, Hansen C. Effects of a short-term vitamin D(3) and calcium supplementation on blood pressure and parathyroid hormone levels in elderly women. J Clin Endocrinol Metab. 2001 Apr;86(4):1633-7. doi: 10.1210/jcem.86.4.7393. ;
[28]: Vaidya A, Forman JP. Vitamin D and hypertension: current evidence and future directions. Hypertension. 2010 Nov;56(5):774-9. doi: 10.1161/HYPERTENSIONAHA.109.140160. ;
[29]: Schleithoff SS, Zittermann A, Tenderich G, Berthold HK, Stehle P, Koerfer R. Vitamin D supplementation improves cytokine profiles in patients with congestive heart failure: a double-blind, randomized, placebo-controlled trial. Am J Clin Nutr. 2006 Apr;83(4):754-9. doi: 10.1093/ajcn/83.4.754. ;
[30]: Larsen T, Mose FH, Bech JN, Hansen AB, Pedersen EB. Effect of cholecalciferol supplementation during winter months in patients with hypertension: a randomized, placebo-controlled trial. Am J Hypertens. 2012 Nov;25(11):1215-22. doi: 10.1038/ajh.2012.111.
[31]: Vanlint, S.: „Vitamin D and Obesity“, in: Nutrients, 2013; 5, S. 949–56. doi:10.3390/nu5030949. URL: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3705328/pdf/nutrients-05-00949.pdf
[32]: Hollis, B.W., Johnson, D., Hulsey, T.C., Ebeling, M. and Wagner, C.L. (2011), Vitamin D supplementation during pregnancy: Double-blind, randomized clinical trial of safety and effectiveness. J Bone Miner Res, 26: 2341-2357. https://doi.org/10.1002/jbmr.463
[33]: Hollis BW, Wagner CL. Vitamin D and pregnancy: skeletal effects, nonskeletal effects, and birth outcomes. Calcif Tissue Int. 2013 Feb;92(2):128-39. doi: 10.1007/s00223-012-9607-4.
[34]: Li YC, et al. Vitamin D: a negative endocrine regulator of the renin-angiotensin system and blood pressure. J Steroid Biochem Mol Biol. 2004;89–90(1–5):387–392. doi: 10.1016/j.jsbmb.2004.03.004.
[35]: Li YC, et al. 1,25-Dihydroxyvitamin D(3) is a negative endocrine regulator of the renin-angiotensin system. J Clin Invest. 2002;110(2):229–238. doi: 10.1172/JCI0215219.
[36]: Lindqvist, P. G. et al. Avoidance of sun exposure is a risk factor for all-cause mortality: results from the Melanoma in Southern Sweden cohort. Journal of Internal Medicine. J Intern Med. 2014 Jul;276(1):77-86. doi: 10.1111/joim.12251
[37]: Rabenberg M, Mensink GBM (2016) Vitamin-D-Status in Deutschland. Journal of Health Monitoring 1(2):36–42 DOI 10.17886/RKI-GBE-2016-036
[38]: Wactawski-Wende J, Kotchen JM, Anderson GL, Assaf AR, Brunner RL, O’Sullivan MJ, Margolis KL, Ockene JK, Phillips L, Pottern L, Prentice RL, Robbins J, Rohan TE, Sarto GE, Sharma S, Stefanick ML, Van Horn L, Wallace RB, Whitlock E, Bassford T, Beresford SA, Black HR, Bonds DE, Brzyski RG, Caan B, Chlebowski RT, Cochrane B, Garland C, Gass M, Hays J, Heiss G, Hendrix SL, Howard BV, Hsia J, Hubbell FA, Jackson RD, Johnson KC, Judd H, Kooperberg CL, Kuller LH, LaCroix AZ, Lane DS, Langer RD, Lasser NL, Lewis CE, Limacher MC, Manson JE; Women’s Health Initiative Investigators. Calcium plus vitamin D supplementation and the risk of colorectal cancer. N Engl J Med. 2006 Feb 16;354(7):684-96. doi: 10.1056/NEJMoa055222. Erratum in: N Engl J Med. 2006 Mar 9;354(10):1102.
[39]: Manaseki-Holland S, Maroof Z, Bruce J, Mughal MZ, Masher MI, Bhutta ZA, Walraven G, Chandramohan D. Effect on the incidence of pneumonia of vitamin D supplementation by quarterly bolus dose to infants in Kabul: a randomised controlled superiority trial. Lancet. 2012 Apr 14;379(9824):1419-27. doi: 10.1016/S0140-6736(11)61650-4.
[40]: Murdoch DR, Slow S, Chambers ST, Jennings LC, Stewart AW, Priest PC, Florkowski CM, Livesey JH, Camargo CA, Scragg R. Effect of vitamin D3 supplementation on upper respiratory tract infections in healthy adults: the VIDARIS randomized controlled trial. JAMA. 2012 Oct 3;308(13):1333-9. doi: 10.1001/jama.2012.12505.
[41]: Wactawski-Wende J, Kotchen JM, Anderson GL, Assaf AR, Brunner RL, O’Sullivan MJ, Margolis KL, Ockene JK, Phillips L, Pottern L, Prentice RL, Robbins J, Rohan TE, Sarto GE, Sharma S, Stefanick ML, Van Horn L, Wallace RB, Whitlock E, Bassford T, Beresford SA, Black HR, Bonds DE, Brzyski RG, Caan B, Chlebowski RT, Cochrane B, Garland C, Gass M, Hays J, Heiss G, Hendrix SL, Howard BV, Hsia J, Hubbell FA, Jackson RD, Johnson KC, Judd H, Kooperberg CL, Kuller LH, LaCroix AZ, Lane DS, Langer RD, Lasser NL, Lewis CE, Limacher MC, Manson JE; Women’s Health Initiative Investigators. Calcium plus vitamin D supplementation and the risk of colorectal cancer. N Engl J Med. 2006 Feb 16;354(7):684-96. doi: 10.1056/NEJMoa055222. Erratum in: N Engl J Med. 2006 Mar 9;354(10):1102.
[42]: Martineau AR, Timms PM, Bothamley GH, Hanifa Y, Islam K, Claxton AP, Packe GE, Moore-Gillon JC, Darmalingam M, Davidson RN, Milburn HJ, Baker LV, Barker RD, Woodward NJ, Venton TR, Barnes KE, Mullett CJ, Coussens AK, Rutterford CM, Mein CA, Davies GR, Wilkinson RJ, Nikolayevskyy V, Drobniewski FA, Eldridge SM, Griffiths CJ. High-dose vitamin D(3) during intensive-phase antimicrobial treatment of pulmonary tuberculosis: a double-blind randomised controlled trial. Lancet. 2011 Jan 15;377(9761):242-50. doi: 10.1016/S0140-6736(10)61889-2.
[43]: Trivedi DP, Doll R, Khaw KT. Effect of four monthly oral vitamin D3 (cholecalciferol) supplementation on fractures and mortality in men and women living in the community: randomised double blind controlled trial. BMJ. 2003 Mar 1;326(7387):469. doi: 10.1136/bmj.326.7387.469.

